|
Oxoàcids
Són composts de fórmula
general HxEyOz,
on E és un
element no metàl·lic o bé un metall de transició amb estat d'oxidació
elevat (per exemple, Cr o Mn). A partir de les normes IUPAC 2005, hi ha
importants canvis en la seva nomenclatura: s'accepten encara bastants
noms tradicionals (amb algunes puntualitzacions), desapareix la
nomenclatura sistemàtica (tipus tetraoxosulfat(VI) d'hidrogen) i es
recomana emprar la nomenclatura d'addició o la d'hidrogen sobretot si
es vol donar informació sobre l'estructura de l'oxoàcid.
Per això,
mantenim les normes de la nomenclatura tradicional i, només per al
batxillerat, comentarem les nomenclatures d'addició i d'hidrogen.
# Amb la nomenclatura tradicional o clàssica
s'anomenen com àcid i a continuació el nom de l'element no metàl·lic
amb la terminació i el prefix adequats per indicar la seva valència.
Recordem els noms tradicionals per indicar les valències:
| Nombres d'oxidació
|
| hipo .......... ós
| -ós
| -ic
| per............ic
| Halògens (Cl, Br, I)
| +1
| +3
| +5
| +7
| Amfígens (S, Se, Te)
| +2
| +4
| +6
|
| Nitrogenoides (N, P, As, Sb)
|
| +3
| +5
|
| Carbonoides (C, Si)
|
|
| +4
|
| Bor
|
|
| +3
|
| Crom
|
|
| +6
|
| Manganès
|
|
| +6
| +7
|
Exemples:
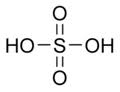
H2SO4
el sofre és
sofre(VI), per tant àcid sulfúric
HClO
el clor és
clor(I), per tant àcid hipoclorós
H3PO4
P(V), per tant àcid fosfòric
HNO2
N(III), per tant àcid
nitrós
HBrO4
el brom és brom(VII), per tant àcid perbròmic
# La nomenclatura d'addició
requereix conèixer l'estructura d'enllaç dels oxoàcids. Aquests, en
general, estan formats per un àtom central envoltat d'una sèrie de
lligants:
- cada hidrogen àcid està unit a un oxigen formant un grup
OH que és el que s'uneix a l'element central. Aquests grups s'anomenen
com a hidròxid amb el prefix que indiqui el seu número.
- la resta d'oxígens estan units directament a l'àtom central. S'anomenen com a òxid amb el prefix multiplicador si és necessari.
- Si hi hagués algun hidrogen no àcid, s'anomena com a hidrur.
El nom es forma
començant pels lligants en ordre alfabètic i finalment s'anomena
l'element central. Per exemple, l'àcid sulfúric H 2SO 4 té com a estructura:
és a dir, té dos grups hidròxid i dos oxígens units al sofre. El seu nom seria:
dihidroxiddioxidsofre
# La nomenclatura d'hidrogen
considera els oxoàcids formats per hidrògens units a un anió. Anomena
primer els hidrògens com di, tri...hidrogen i a continuació l'anió
entre parèntesi d'acord amb l'esquema: (prefix)oxid(prefix)element-at.
(Vegeu més detall a l'apartat d'ions). Per exemple, l'àcid sulfúric H 2SO 4, amb 2 H i 4 O seria:
dihidrogen(tetraoxidsulfat)
Exemples:
| Tradicional
| Hidrogen
| Addició |
HClO
| àcid hipoclorós
| hidrogen(oxidclorat)
| hidroxidclor |
HNO2
| àcid nitrós
| hidrogen(dioxidnitrat)
| hidroxidoxidnitrogen |
| H2CrO4
| àcid cròmic
| dihidrogen(tetraoxidcromat)
| dihidroxiddioxidcrom |
| H2CO3 | àcid carbònic
| dihidrogen(trioxidcarbonat)
| dihidroxidoxidcarboni |
| HMnO4 | àcid permangànic
| hidrogen(tetraoxidmanganat)
| hidroxidtrioxidmanganès |
# Es poden formular fent primer la fórmula de
l'òxid de l'element i a continuació sumant-li una molècula d'aigua. Per
exemple, per
formular l'àcid sulfúric, primer formulam l'òxid de sofre(VI), SO3,
i després li sumam aigua: SO3 +
H2O = H2SO4.
Més exemples:
| àcid carbònic |
CO2 + H2O |
 |
|
 |
H2CO3 |
| àcid clorós |
O3Cl2 + H2O |
 |
H2Cl2O4 |
 |
HClO2 |
| àcid perclòric |
O7Cl2 + H2O |
 |
H2Cl2O8 |
 |
HClO4 |
EXERCICIS
1. Formula: àcid periòdic, hidroxidoxidclor (àcid clorós),
àcid selenós, àcid sulfhídric, àcid bròmic, àcid sulfurós, àcid nítric,
hidrogen(tetraoxidbromat), àcid hipobromós, àcid clorhídric, àcid
cròmic, àcid mangànic y àcid permangànic.
2. Anomena: H2TeO3,
HBrO, HIO3, HMnO4, H2CO3, H2CrO4.
Per a la nomenclatura tradicional, hauràs de cercar primer el nombre d'oxidació de l'element central
recordant que l'oxigen té -2 i l'hidrogen +1.
3.Hauràs sentit parlar d'un tipus de contaminació molt de
moda actualment, la pluja àcida. Investiga en què consisteix i si
coneixes a Mallorca alguna possible font d'aquesta contaminació.

OXOACIDS POLIHIDRATATS
Són oxoàcids formats per la unió
d'una molècula d'òxid amb 2 o més molècules d'aigua. En els següents elements, són els acids més comuns: B, Si, P, As i Sb.
# Es formulen addicionant a una molècula d'òxid un nombre
convenient de molècules d'aigua:
# S'anomenen amb la nomenclatura tradicional emprant els prefixos meta quan
s'addiciona una molècula d'aigua i orto quan se n'adiciona més
d'una. (*)
- el prefix meta indica una molècula d'aigua
- el prefix orto indica 2 molècules d'aigua per als elements de
valència parell i 3 molècules d'aigua per als de valència senar.
(*) El prefix orto no s'ha d'especificar en el cas de B, Si, P, As i Sb. Per exemple, si veim àcid fosfòric, àcid fosforós, àcid
bòric..., ens referim als àcids ortofosfòric, ortofosforós i
ortobòric., encara que no es posa el prefix al nom.
El prefix meta només s'ha d'especificar en el cas de B, Si, P, As i Sb. Per als altres elements, no s'especifica.
# Pel que fa a les nomenclatures d'addició i d'hidrogen, funcionen exactament igual que en els àcids en general.
Exemples:
àcid metafosfòric
|
P2O5 + H2O |
 |
H2P2O6 |
 |
HPO3 |
àcid fosfòric (orto)
|
P2O5 + 3H2O |
 |
H6P2O8 |
 |
H3PO4 |
| àcid silícic (orto) |
SiO2 + 2H2O |
 |
H4SiO4 |
|
|
| àcid bòric (orto) |
B2O3 + 3H2O |
 |
H3BO3 |
|
|
| àcid fosforós (orto) |
P2O3 + 3H2O |
 |
H3PO3 |
|
|
| àcid arsèniós |
As2O3 +3H2O |
 |
H6As2O6 |
 |
H3AsO3 |
hidroxidioxidfosfor / hidrogen(trioxidfosfat)
|
HPO3 |
|
|
|
|
trihidroxidoxidfosfor / trihidrogen(tetraoxidfosfat)
|
H3PO4 |
|
|
|
|

ISOPOLIACIDS
Són àcids que contenen a la seva
molècula més d'un àtom de l'element central. Són freqüents els diàcids,
que en contenen dos. Aquests s'anomenen emprant el prefix di.
# Es formulen afegint 2 molècules d'aigua a una d'òxid per
als elements de valència senar o afegint 1 molècula d'aigua a dues
molècules d'òxid per als elements de valència parell. Exemples:
| àcid difosfòric |
P2O5 + 2H2O |
 |
H4P2O7 |
| àcid disulfúric |
2 SO3 + H2O |
 |
H2S2O7 |
| àcid dicròmic(*) |
2 CrO3 + H2O |
 |
H2Cr2O7 |
# Els diàcids també es poden formular restant una molècula
d'aigua a dues molècules d'àcid. Així:
| àcid difosfòric |
2 H3PO4 - H2O |
 |
H4P2O7 |
| àcid disulfúric |
2 H2SO4 - H2O |
 |
H2S2O7 |
| àcid difosforós |
2 H3PO3 - H2O |
 |
H4P2O5 |
| àcid dicròmic(*) |
2 H2CrO4 - H2O |
 |
H2Cr2O7 |
# Els triàcids i/o poliàcids no segueixen una norma general.
(*) Només en vistes a fer els dicromats
|