
|
INTRODUCCIO Aquests
apunts estan adapatats a les recomanacions de la IUPAC de l'any 2005
sobre nomenclatura inorgànica sistemàtica i al document elaborat pel
Seminari de Química "Del Batxillerat a la Universitat" de l'any 2013. # A cada element se li assigna un símbol format per una o dues lletres, generalment la inicial del seu nom i, si cal, una altra lletra per diferenciar-lo d'un altre element amb la mateixa inicial: carboni, C ; clor, Cl; calci, Ca; urani, U; cadmi, Cd.... De vegades, les inicials corresponen al nom llatí o grec de l'element: sodi, Na (natrium); potassi, K (kalium); coure, Cu (cuprum) Pots veure el sistema
periòdic amb els símbols i valències dels elements
més comuns, que convé conèixer per a la formulació.
Si passes el ratolí per sobre dels elements veuràs més
informació. # A cada element se li assigna també un nombre, el nombre d'oxidació per ajudar a conèixer en quina proporció es combina amb els altres elements. El nombre d'oxidació de vegades designa el nombre d'electrons que l'element perd o guanya quan es combina amb altres elements. D'altres vegades no té una interpretació química tan senzilla, però ens serà igualment útil per formular. Pots veure els nombres d'oxidació més comuns dels principals elements al sistema periòdic. Per a la seva importància, et convé començar a memoritzar-los. Aquest exercici et pot ajudar: nombres d'oxidació. Es tracta d'associar a cada element el seu conjunt de nombres d'oxidació.
Hi
ha elements que tenen tan sols un estat d'oxidació i d'altres que en
tenen uns quants. El nom d'un compost haurà d'especificar d'alguna
manera quin nombre d'oxidació té cadascun dels elements que el formen,
sobretot si en poden tenir més d'un. També es pot especificar la
composició de la substància (el nombre d'àtoms de cada element que
conté). Hi ha unes quantes formes d'anomenar el composts per donar
aquesta informació:
A partir d'ara treballarem la nomenclatura i formulació dels diferents tipus d'elements i composts. ELEMENTS (sense combinar) # Els elements, quan es troben sense combinar, es formulen simplement escrivint el símbol de l'element, excepte uns quants gasos que es presenten sempre formant molècules diatòmiques i es formulen posant-los un subíndex 2, i altres casos com l'ozó (O3), el fòsfor blanc (P4)...: H2,
N2, O2, F2, Cl2, Br2,
I2.
COMPOSTS BINARIS En els composts binaris, és a dir, formats per tan sols dos elements, haurem de recórrer al nombre d'oxidació de cadascun d'ells per saber en quina proporció de nombre d'àtoms es combinen. Així per exemple, a un compost format per oxigen(2-) i sodi(1+), caldrà combinar 2 àtoms de sodi per cada 1 d'oxigen; el nombre d'àtoms de cada element es posa com un subíndex del símbol de l'element: Na2O
Pel que fa a l'ordre de col·locació dels elements a una fórmula, se segueix el criteri d'escriure a la dreta els més electronegatiu d'acord amb la següent seqüència. Cal destacar el fluor com a més electronegatiu i la posició de l'hidrogen, just abans del nitrogen. 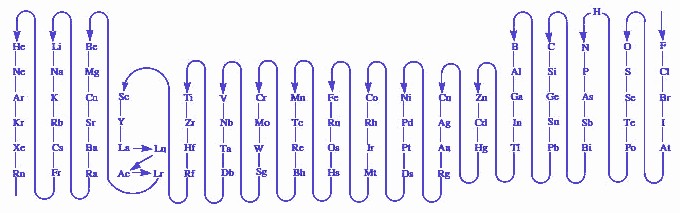
(*)
Generalment, quan tots els subíndex d'una fórmula es puguin
simplificar, se simplifiquen per donar la fórmula del compost. Hi ha
algunes excepcions com els peròxids i alguns composts que presenten
estructura dímera. Per a la seva nomenclatura, en general es fa acabar el nom de l'element més electronegatiu en -ur (excepte quan l'oxigen és el més electronegatiu que s'anomena com a òxid) i a continuació es posa de
i el nom de l'altre element. En cas d'ambigüitat, cal indicar la
proporció en què es troben, ja sigui empant multiplicadors, nombres
d'oxidació o de càrrega (l'element més electronegatiu té el nombre
d'oxidació negatiu i l'altre, positiu). Exemples:
(*) No recomanada
A partir d'ara, veurem com s'anomenen i formulen els principals
tipus de composts. |
|
HIDRURS i altres composts binaris amb hidrogen Es coneixen amb aquest nom els composts resultants de la combinació de l'hidrogen amb un altre element qualsevol. Per facilitar la seva nomenclatura, els podem dividir en: a) Combinacions de metall + hidrogen (nombre d'oxidació -1) HIDRURS METÀL·LICS # S'anomenen com:
# Es formulen escrivint l'hidrogen a la dreta. Exemples:
b) Combinacions de no metall + hidrogen Podem dividir-los en dos grups: b.1) Combinacions dels elements dels grups 16 i 17 amb hidrogen: hidrogen (+1) i no metall (nombre oxidació negatiu)
Exemples:
b.2) Combinacions dels elements dels grups 13, 14 i 15 : no metall(nombre d'oxidació positiu) + hidrogen(-1)
Exemples:
EXERCICIS: 1. Formula: hidrur de potassi, hidrur de bari, àcid selenhídric, clorur d'hidrogen, trihidrur d'alumini, iodur d'hidrogen, hidrur de cèsi. 2. Anomena: MgH2, PbH4, CuH, SbH3, H2Se, H2S, NH3, HgH2. 3. Investiga el que puguis sobre l'àcid clorhídric, l'àcid sulfhídric, el metà i l'amoníac. Quan
hagis repassat els hidrurs, òxids i binaris metall-no metall, podràs
practicar amb els exercicis fórmules1
,noms1 ,noms2
i fórmules2. |
|
|